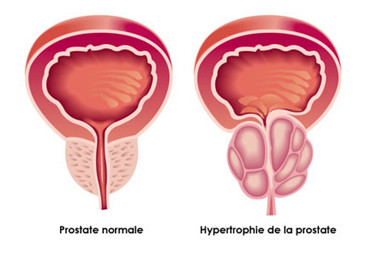
Alfuzosin có tác dụng ngăn chặn tiến triển u tuyến cổ bàng quang gây chứng bí tiểu ở cả nam và nữ giới. Liều dùng từ 5 mg - 10 mg/ngày, có thể sử dụng cả ở dạng uống và tiêm. Viên nén chứa 2,5 mg alfuzosin hydrochloride với các tá dược lactose, polyvidon, cellulose vi tinh thể, natri carboxymethylamide, magie stearate. Thuốc tiêm thường được đóng 5 mg/ampoul, truyền cùng với dung dịch nước muối đẳng trương. Tác động của thuốc còn làm giãn các cơ trong tuyến tiền liệt và bàng quang, giúp cho nước tiểu thoát ra dễ dàng nên được ưa dùng trong điều trị nhiều bệnh lý đường tiết niệu. Ngoài ra, Alfuzosin còn có tác dụng chống cao huyết áp mạnh. Alfuzozin tương đối ít tác dụng phụ, nhưng vẫn phải thận trọng khi bệnh nhân có bất thường về huyết áp. Tháng 6/2003, US-FDA đã chính thức phê chuẩn Uroxatral làm thuốc điều trị chứng phì đại tuyến tiền liệt tại Mỹ.Sau phát kiến của Manoury, các công nghệ điều chế alfuzosin trên thế giới đều được phát triển theo hướng tổng hợp toàn phần từ hợp chất đầu (chất 1) là 4-amino-2-chloro-6,7-dimethoxyquinazoline (chất 2).
Tùy thuộc vào trình độ công nghệ và mức độ đầu tư, các phương pháp được lựa chọn áp dụng 2 phương pháp sẽ là: “Tổng hợp trực tiếp alfuzosin từ chất 2” và “Tổng hợp mạch phụ N-(3-(methylamino)-propyl)-tetrahydrofuran-2- carboxamide từ axít tetrahydrofuranoic rồi sau đó ghép đôi với chất 2”.
Theo hai phương pháp nêu trên, các giải pháp kỹ thuật thay thế xúc tác, tác nhân nhằm rút ngắn thời gian, cải thiện điều kiện thực hiện phản ứng, nâng hiệu suất các bước tổng hợp và hạ giá thành alfuzosin cũng được công bố và áp dụng trong công nghiệp.
Từ kết quả tham khảo tài liệu, căn cứ vào trình độ công nghệ của Việt Nam, căn cứ vào năng lực kỹ thuật trong nước và kết quả đạt được từ quá trình nghiên cứu thăm dò nhóm nghiên cứu do GS.TSKH. Mai Tuyên, Viện Hóa học công nghiệp Việt Nam đứng đầu đã tiến hành nghiên cứu đề tài: “Nghiên cứu quy trình công nghệ tổng hợp Alfuzosin làm nguyên liệu sản xuất thuốc” dựa trên phương pháp thứ hai vì đây là phương pháp phù hợp nhất với các điều kiện Việt Nam.
Đây là lần đầu tiên ở Việt Nam đặt vấn đề nghiên cứu hoàn thiện công nghệ tổng hợp Afuzosin hydrochloride. Thực hiện thành công đề tài này sẽ tạo ra một công nghệ sản xuất sản phẩm mới cho ngành Hóa Dược trong nước, góp phần chủ động sản xuất một loại thuốc chữa bệnh thiết yếu tại Việt Nam.
Sau một thời gian nghiên cứu, nhóm nghiên cứu đã thu được các kết quả như sau:
1. Đã xây dựng và hoàn thiện được quy trình công nghệ tổng hợp Alfuzosin hydrochloride làm nguyên liệu sản xuất thuốc, cụ thể:
- Nghiên cứu quy trình este hóa axít tetrahydrofuranoic theo phương pháp gián đoạn và phương pháp dòng liên tục sử dụng tháp xúc tác Diaion HP20; đồng thời khảo sát các thông sốtối ưu của các phương pháp và lựa chọn phương pháp dòng liên tục để tiến hành thực hiện trong quy mô Pilot vì đây là phương pháp có nhiều ưu điểm như: thưc̣ hiêṇ đơn giản, thời hạn thực hiện ngắn, hiệu suất phản ứng cao với chi phí sản xuất thấp, không phải tinh chế nên không bị hao hụt sản phẩm.
- Nghiên cứu quy trình công nghệ tổng hợp và tinh chế Tetrahydro-N-(3-(methylamino)-propyl)furan-2-carboxamide (6); đồng thời khảo sát các thông số tối ưu và lựa chọn được quy trình tổng hợp để có được hiệu suất phản ứng là cao nhất
+ Nghiên cứu hoàn thiện quy trình công nghệ tổng hợp và tinh chế Alfuzosin; đồng thời khảo sát các thông sốtối ưu vàlưạ choṇ đươc̣ quy trình tổng hợp để có được hiệu suất phản ứng là cao nhất. Xác định được cấu trúc sản phẩm đúng như các kết quả đã công bố.
+ Nghiên cứu hoàn thiện quy trình công nghệ tạo muối và tinh ch Alfuzosin hydrochloride ; đồng thời khảo sát các thông sốtối ưu vàlưạ chọn được quy trình tổng hợp để có được hiệu suất phản ứng là cao nhất . Xác định được cấu trúc sản phẩm đúng như các kết quả đã công bố.
2. Xây dựng, thử nghiệm và ổn định quy trình công nghệ gián đoạn tổng hợp Alfuzosin hydrochloride quy mô pilot 0,5 kg/mẻ. Chạy thử nghiệm với 3 mẻ sản phẩm với điều kiện tương đương nhau cho kết quả không thay đổi cho thấy công nghê ̣lưạ choṇ làtối ưu vàđaṭhiêụ quảcao. Sản phẩm thu được đã đươc̣ chứng minh cấu trúc bằng các bô ̣phổNMR, MS, XRD.
3. Sản phẩm Alfuzosin hydrochlorid là sản phẩm của đề tài đã được khảo sát cho thấy không bi ̣thay đổi nhiều về hàm lượng và các tính chất hóa lý khác. Riêng chỉ tiêu hàm lượng̣ nước là có sư ̣thay đổi lớn trong 12 tháng theo dõi. Điều đó chứng tỏ nguyên liệu Alfuzosin hydrochlorid rất dê ̃hút ẩm và không ổn đinḥ nếu bảo quản ởđiều kiêṇ thường (nhiệu độ 30 độ C ± 2 độ C và độ ẩm tương đối 75% ± 5%). Vì vậy cần phải bảo quản nguyên liệu Alfuzosin hydrochlorid ở điều kiện đặc biệt (nhiệt độ thấp và tránh hút ẩm) hoặc sử dụng thêm một số phụ gia hóa dược chuyển nguyên liệu này thành dạng sản phẩm bền vững hơn.
4. Mẫu Alfuzosin hydrochlorid thử độc tính cấp cho thấy: ở mức liều thấp (2,0g mâũ thử / kg chuột). Chuột có biểu hiện giảm hoạt động nhưng không có chuột chết, ở mức liều trong khoảng từ 3,0 g đến 6,0 g /kg chuột, chuột có biểu hiện nằm mệt , thở gấp , giảm hoạt động . Chuột bị chết trong khoảng thời gian 24, 48, 72 và 96 giờ theo dõi và tỉ lệ tùy theo mức liều uống.
5. Mẫu Alfuzosin hydrochlorid thử độc bán trường diễn cho thấy : Sau khi cho thỏ uống dung dịch mẫu thử trong nước liên tục trong 28 ngày với mức liều 0,6 mg hoaṭchất / kg thỏ/ ngày và 1,8 mg / kg thỏ/ ngày, kết quả thu được cho thấy không có sự khác nhau về chỉ sinh hóa và huyết học giữa nhóm đối chứng và 2 nhóm thử. Cân nặng̣ của thỏ thí nghiệm trong các nhóm thử so với nhóm đối chứng không có sự khác biệt có ý nghĩa thống kê. Không nhận thấy sự bất thường về hình dạng bên ngoài, mầu sắc của tổ chức tim, gan, thận, phổi và hệ tiêu hóa giữa các thỏ nhóm đối chứng và nhóm thử sau thí nghiệm.
Từ các kết quả nghiên cứu triển khai Đề tài CNHD.ĐT.005/09-11 “Nghiên cứu quy trình công nghệ tổng hợp Alfuzosin hydrochloride làm nguyên liệu sản xuất thuốc”, Viện Hóa học công nghiệp Việt Nam kiến nghị Nhà nước tiếp tục hỗ trợ nghiên cứu Pha II điều chế dạng sản phẩm phù hợp với tính chất của hoạt chất này và phù hợp với việc bào chế thành phẩm viên nén. Thực hiện thành công pha II sẽ tạo cơ sở khả thi cho việc phát triển kết quả nghiên cứu của đề tài sang dự án sản xuất hóa dược Alfuzosin hydrochloride làm nguyên liệu sản xuất thuốc điều trị u tiền liệt tuyến lành tính.
Có thể tìm đọc toàn văn Báo cáo kết quả nghiên cứu của Đề tài (Mã số 13175-2016) tại Cục Thông tin khoa học và công nghệ quốc gia.